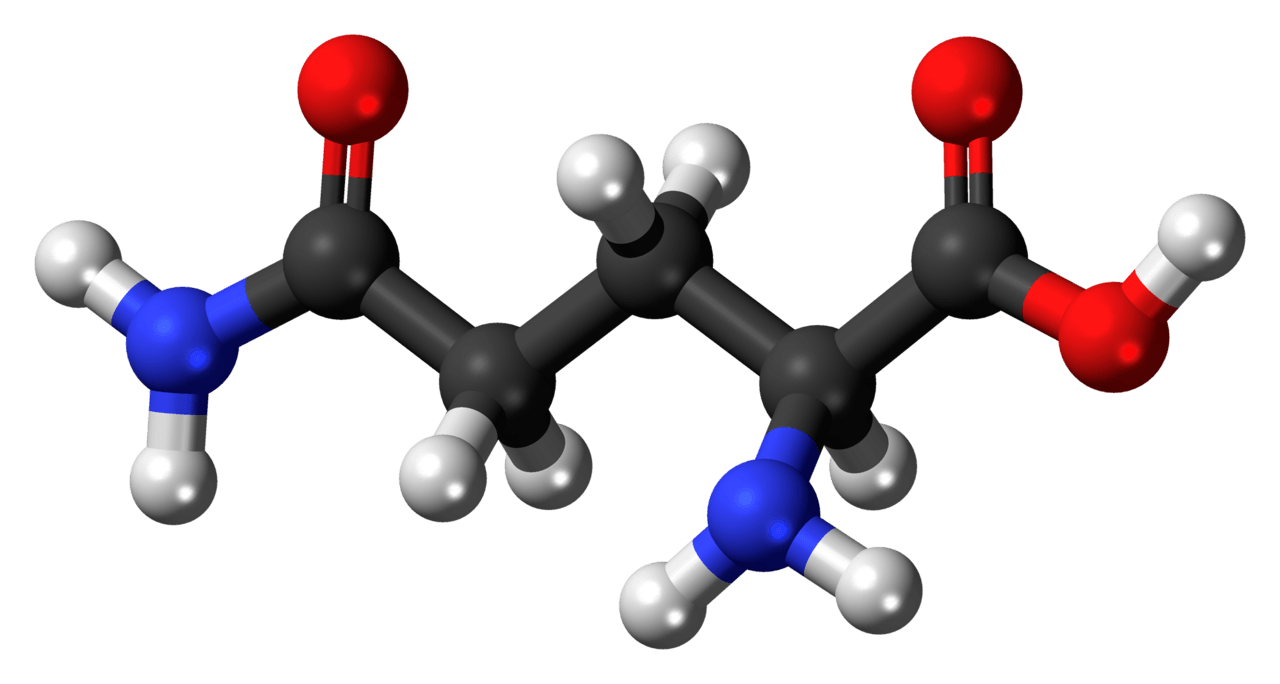
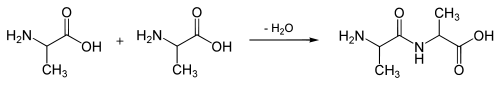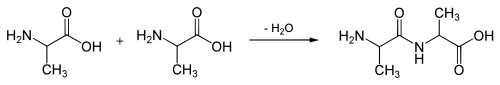TYROSINE
C9H11NO3
IUPAC-naam Tyrosine
Andere namen onder andere: [1]
2-amino-3-(4-hydroxyfenyl)-propaanzuur
α-amino-para-hydroxyhydrokaneelzuur
2-amino-3-(p-hydroxyfenyl)-propionzuur
3-(p-hydroxyfenyl)alanine
α-amino-4-hydroxybenzeenpropaanzuur
4-hydroxyfenylalanine
Waarschuwingen en veiligheidsmaatregelen
Schadelijk
Goed oplosbaar in zure en alkalische oplossingen
Matig oplosbaar in water
Onoplosbaar in di-ethylether, aceton
Nutritionele eigenschappen
Essentieel? semi-essentieel
Het woord tyrosine komt van het Griekse woord tyros (τυρός), dat 'kaas' betekent. In 1846 werd tyrosine voor het eerst geïsoleerd door Justus von Liebig uit caseïne, waarin het in relatief grote hoeveelheden voorkomt.
Kaas (vooral Hüttenkäse en ricotta), kwark en melk zijn goede bronnen van tyrosine.
De kleine witte vlekken die soms op kaas zichtbaar zijn, zijn tyrosinekristallen. Die getuigen van proteolyse (de afbraak van eiwitten tot aminozuren) die plaatsvond tijdens het rijpen van de kaas.
Andere voedselbronnen van tyrosine zijn eiwitrijke producten, zoals eieren, rund- en varkensvlees, gevogelte, vis en schaal- en schelpdieren.
Ook in eiwitrijk plantaardig voedsel zoals tarwekiemen, havervlokken, amandelen, pecannoten, pompoenpitten, sesamzaad, limabonen, avocado's, kikkererwten, linzen, sojabonen en zonnebloempitten komt tyrosine veel voor.
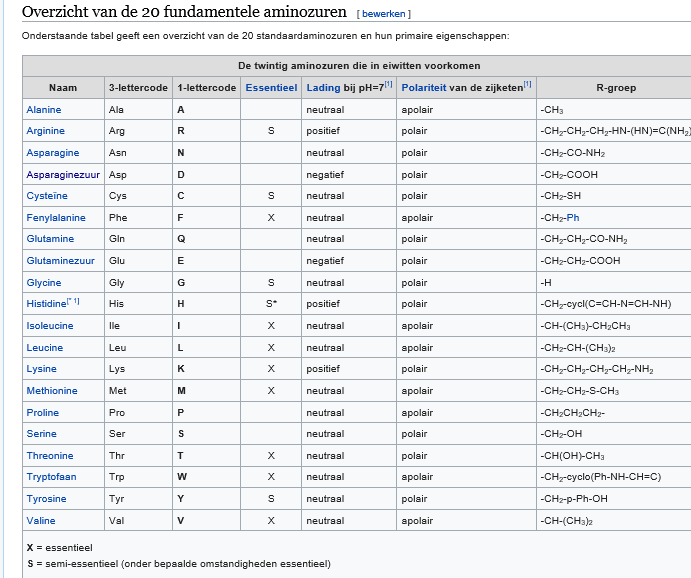
Tyrosine (afgekort als Tyr of Y)[a] is een relatief groot, hydrofiel aminozuur met een aromatische zijketen.
Als een van de twintig natuurlijk voorkomende α-aminozuren die voor eiwitsynthese worden gebruikt, maakt tyrosine deel uit van vrijwel elk eiwitmolecuul in alle levensvormen.
Tyrosine wordt meestal geclassificeerd als een voor mens en dier niet-essentieel aminozuur omdat het lichaam (onder normale omstandigheden) voldoende tyrosine kan vormen uit het wel essentiële aminozuur fenylalanine.
Tyrosine is uitgangsstof voor de aanmaak van een aantal belangrijke hormonen en neurotransmitters.
Deze signaalmoleculen vormen een centraal onderdeel van het sympathisch zenuwstelsel en hun concentraties in het lichaam en de hersenen zijn rechtstreeks afhankelijk van de opname van tyrosine uit voedsel of van biosynthese.
Ook is het de voornaamste grondstof van het organische pigment melanine, dat verantwoordelijk is voor haar- en huidskleur.
Tyrosine speelt eveneens een belangrijke rol bij communicatieprocessen in de cel (signaaltransductie), bijvoorbeeld bij het veroorzaken van veranderingen in de cel als gevolg van koppeling van een hormoon aan een membraanreceptor, dan wel het reguleren van enzymatische activiteit.
Tyrosine bestaat in twee vormen, de enantiomere L- en D-vormen, waarvan alleen de L-vorm natuurlijk voorkomt.
Vanwege de aanwezigheid van een fenolische hydroxylgroep, is het een polair aminozuur.
Tyrosine bezit door zijn bijzondere structuur zowel hydrofiele als hydrofobe eigenschappen. Het wordt tyrosyl genoemd wanneer ernaar verwezen wordt als functionele groep of zijketen.
Een tekort aan tyrosine (en zijn precursor fenylalanine) veroorzaakt een tekort aan dopamine en noradrenaline, wat gepaard gaat met onder meer depressie en apathie.
De werking van tyrosinesuppletie is onderzocht bij onder meer de volgende aandoeningen: depressie, stress, ontwenningsverschijnselen na het stoppen met cocaïne, bij de ziekte van Parkinson, fenylketonurie en narcolepsie, de effectiviteit ervan werd daarbij lang niet altijd aangetoond.
Tyrosine wordt als voedingssupplement verkocht en wordt gereguleerd volgens Europese richtlijnen.[b]
Tyrosine is een proteïnogeen aminozuur: het is een van de twintig natuurlijk voorkomende bouwstenen van eiwitten. Aminozuren zijn kleine organische moleculen. Ze koppelen in de cel in zeer grote aantallen aan elkaar en vormen dan lange aminozuurketens.
Deze ketens kunnen zich vervolgens opvouwen waardoor een eiwit ontstaat met een specifieke ruimtelijke structuur.
Eiwitten regelen de stofwisseling, het transport en de communicatie van cellen in alle levensvormen: in planten, dieren, schimmels en bacteriën.
Ze geven vorm en stevigheid aan losse cellen en houden de cellen binnen een meercellig organisme bijeen. Direct en indirect is tyrosine betrokken bij alle levensprocessen.
De volgende voorbeelden geven een overzicht van het tyrosinegehalte in verschillende levensmiddelen. Naast de hoeveelheid tyrosine per 100 gram levensmiddel is het procentuele aandeel van tyrosine in het voedingseiwit aangegeven:[5]
Levensmiddel Totaal proteïne Tyrosine Aandeel
Varkensvlees, rauw 20,95 g 797 mg 3,8%
Kippenborstfilet, rauw 21,23 g 765 mg 3,6%
Zalm, rauw 20,42 g 759 mg 3,7%
Kippenei 12,56 g 499 mg 4,0%
Koemelk, 3,7% vet 3,28 g 158 mg 4,8%
Pompoenpitten 30,23 g 1093 mg 3,6%
Walnoten 15,23 g 406 mg 2,7%
Tarwemeel 10,33 g 312 mg 3,0%
Maismeel 6,93 g 282 mg 4,1%
Rijst, ongepeld 7,94 g 298 mg 3,8%
Sojabonen, gedroogd 36,49 g 1539 mg 4,2%
Erwten, gedroogd 24,55 g 711 mg 2,9%
Al deze voedingsmiddelen bevatten vrijwel uitsluitend L-tyrosine dat als eiwitbestanddeel gebonden is, en vrijwel geen vrij L-tyrosine.
Gemiddeld bestaat voedingseiwit voor 4% uit tyrosine en voor 4,5 tot 5% uit fenylalanine.
Afhankelijk van het aanbod tyrosine in de voeding vindt aanvulling plaats vanuit het aminozuur fenylalanine.
Dit is een essentieel aminozuur, en moet dus via de voeding worden verkregen. Naar schatting wordt 67–90% van de fenylalanine in de voeding in tyrosine omgezet. Bij onvoldoende aanvoer van fenylalanine wordt tyrosine essentieel.
De gezamenlijke dagelijkse behoefte aan tyrosine en fenylalanine is weergegeven in onderstaande tabel. Een gemiddelde voeding levert per dag ongeveer 3,5 gram fenylalanine en 3 gram tyrosine. Dit voorziet meestal ruimschoots in de behoefte.
Schatting van de dagelijkse aminozuurbehoefte[6]
Aminozuurbehoefte in mg per kg lichaamsgewicht Zuigelingen 3 à 4 maanden Peuters circa 2 jaar Kinderen circa 10 à 12 jaar Volwassenen
Fenylalanine plus tyrosine 125 69 22 14
Het kunstmatig opwekken van een tekort aan tyrosine (en dus gelijktijdig van fenylalanine) bij mensen of proefdieren leidt tot verminderde activiteit van catecholamines in de hersenen.
Dit gaat onder meer gepaard met een verminderde stresstolerantie, verminderde geheugenfunctie en neiging tot apathie.
Biochemie en synthese
Eigenschappen
L-tyrosine (links) en D-tyrosine (rechts). Alleen L-tyrosine is fysiologisch actief.
Tyrosine is een reukloze vaste stof die kristallen vormt en die over het algemeen een witachtig uiterlijk heeft.
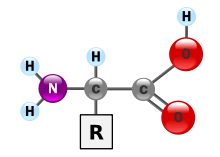
Zoals alle aminozuren bestaat tyrosine uit vijf componenten, namelijk een centraal koolstofatoom die vier verschillende groepen draagt: een zuurgroep, een aminogroep, een waterstofatoom en een variabele groep, die in het geval van tyrosine een methylfenolgroep is.
De algemene formule van tyrosine is R—CH(NH2)—COOH. De R staat voor Residu-groep, waarbij R=—CH2—p—Fenyl—OH.
Tyrosine is een belangrijke bouwsteen van eiwitten.
In organismen worden aminozuren gecodeerd door drie opeenvolgende basen (een codon), die gelegen zijn in het messenger RNA.
Tyrosine wordt gecodeerd door de codons UAC en UAU.
De aromatische ring in het molecuul is echter hydrofoob waardoor tyrosine zowel hydrofiele als hydrofobe eigenschappen kan vertonen, afhankelijk van de omstandigheden.
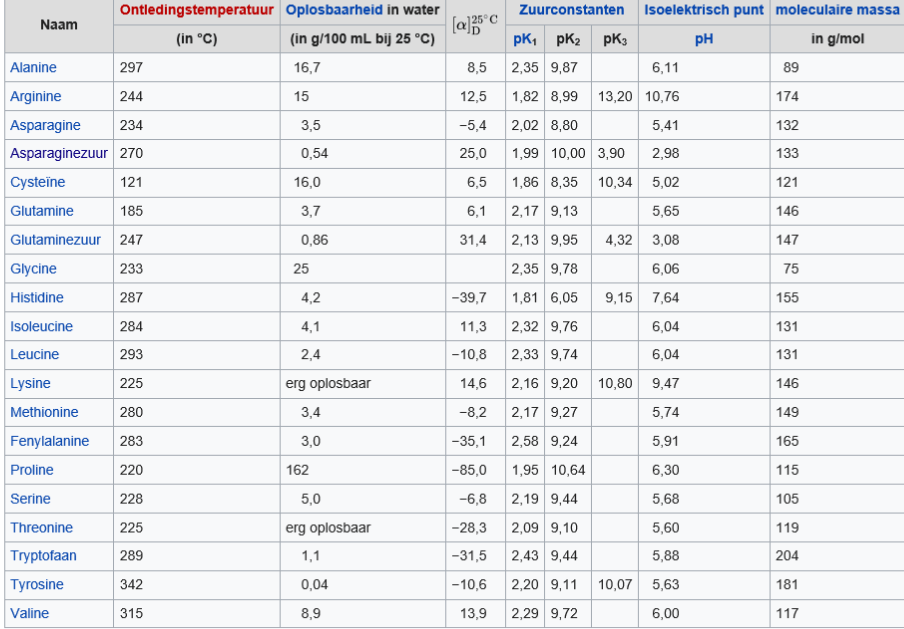
Een combinatie van deze eigenschappen[c] maakt dat tyrosine matig oplosbaar is in water (479 mg/L). Zo kan tyrosine, samen met tryptofaan, beschouwd worden als een amfifiel molecuul.
Tyrosine vertoont, net als de meeste andere aminozuren (behalve glycine), optische isomerie waardoor twee configuraties van het tyrosinemolecuul mogelijk zijn: D (Dextro) en L (Laevo). Alleen de L-vorm is fysiologisch actief.
Tyrosine absorbeert ultraviolet licht. De absorptie van licht (extinctie) hangt onder andere af van de molaire extinctiecoëfficiënt. Deze grootheid is gerelateerd aan de soort stof en de golflengte van het licht.
Tyrosine heeft zijn hoogste extinctie bij een golflengte van tussen de 260 en 300 nm. Bij een hoge pH (pKa = 10) staat de hydroxylgroep zijn proton af, waardoor de extinctie van tyrosine naar hogere golflengtes (richting het rood) verschuift.
Biosynthese in planten en micro-organismen
Biosynthese van tyrosine in planten, vanuit shikiminezuur.
Planten en de meeste micro-organismen synthetiseren L-tyrosine via prefenaat, een tussenproduct van de shikiminezuurroute.
Deze stofwisselingsroute is een belangrijke route voor de synthese van aminozuren, co-enzym Q10, tocoferolen, naftochinonen (inclusief de vitamines uit de K-groep), alkaloïden en heterocyclische natuurstoffen.
Daarbij wordt uit koolhydraatprecursors shikimaat gevormd en via een reeks enzymatische reacties in chorismaat omgezet.
Daarna katalyseert chorismaatmutase de omzetting van chorismaat in prefenaat op het vertakkingspunt bij de biosynthese van aromatische aminozuren zoals tyrosine en fenylalanine.
Prefenaat wordt oxidatief gedecarboxyleerd om p-hydroxyfenylpyruvaat te vormen. Hierbij wordt de hydroxylgroep behouden. Vervolgens wordt dit molecuul getransamineerd met behulp van glutamaat als stikstofbron om uiteindelijk tyrosine en α-ketoglutaraat te vormen.
Biosynthese in dieren en in de mens
Biosynthese van tyrosine in dieren en bij de mens, uit fenylalanine
Terwijl mensen en dieren de meeste andere niet-essentiële aminozuren kunnen synthetiseren uit glucose en ammonia, kan tyrosine uitsluitend gesynthetiseerd worden uit het essentiële aminozuur fenylalanine dat uit de voeding afkomstig is.
Fenylalanine en tyrosine zijn sterk overeenkomende aminozuren, met als belangrijkste verschil dat tyrosine (ook wel para-hydroxyfenylalanine genoemd) een hydroxylgroep aan de aromatische ring bevat (op de para-positie).
Daardoor is de zijketen (residu-groep) van tyrosine minder hydrofoob dan bij fenylalanine het geval is (dat geen hydroxylgroep aan de aromatische ring heeft).
Bij de aanmaak van tyrosine uit fenylalanine wordt een hydroxylgroep aan de fenylring van L-fenylalanine toegevoegd op de para-positie.
De omzetting vindt plaats in de lever, nieren en hersenen en onder normale omstandigheden is de productie toereikend.
Het enzym dat de reactie katalyseert is fenylalaninehydroxylase. Dit enzym maakt deel uit van de grotere groep enzymen die een hydroxylgroep kunnen binden aan substraten: de mono-oxygenasen.
In de reactie treedt biopterine op als cofactor. De reactie is onomkeerbaar; synthese van fenylalanine uit tyrosine is niet mogelijk.
Bij prematuur geboren kinderen en bij mensen met leverziekten verloopt deze (enzymatische) omzetting moeizaam.
Bij mensen met de stofwisselingsziekte fenylketonurie (PKU) is het enzym fenylalaninehydroxylase helemaal niet actief. In deze omstandigheden kan tyrosine een essentieel aminozuur worden.
Er zijn drie isomeren van tyrosine.
Het gebruikelijke para-isomeer dat in het lichaam gebruikt kan worden ontstaat door enzymatische oxidatie. In omstandigheden van oxidatieve stress kan vorming van tyrosine uit fenylalanine ook plaatsvinden door niet-enzymatische oxidatie als gevolg van hydroxylradicalen.
Daarbij ontstaan de zeldzame isomeren meta-tyrosine en ortho-tyrosine.
Drie isomeren van tyrosine, gevormd door enzymatische oxidatie of hydroxylering
Het feit dat tyrosine een voorloper is van catecholamines, melanine en thyroxine heeft invloed op de synthese.
De tyrosine-productie wordt gereguleerd door de vraag naar deze moleculen. Vrij L-tyrosine wordt niet in grote hoeveelheden in het lichaam gevonden omdat het snel wordt omgezet.
Foliumzuur, koper en vitamine C zijn belangrijke cofactor-voedingsstoffen voor deze omzettingen.
Industriële productie
Aminozuren kunnen industrieel worden geproduceerd door bronnen van eiwitten te denatureren en te hydrolyseren. De hydrolyse vindt plaats door proteolytische enzymen of door sterke zuren zoals zoutzuur. De verkregen aminozuren, di-, tri- en oligopeptiden kunnen worden gescheiden door middel van centrifugatie, (ultra)filtratie en ionenuitwisselingschromatografie.[13]
Hydrolyse in een zuur milieu van (keratinehoudende) eiwitten geeft na neutralisatie een proteïnehydrolysaat, dat uit de 20 α-aminozuren bestaat die voor eiwitsynthese worden gebruikt.
Daaruit kan op eenvoudige wijze een fractie worden gewonnen die rijk is aan L-cysteïne- en L-tyrosine, namelijk door afscheiding van de goed wateroplosbare aminozuren, aangezien L-cysteïne en L-tyrosine relatief slecht in water oplosbaar zijn.
Tot op de dag van vandaag wordt de meeste tyrosine volgens deze eenvoudige scheidingsmethode commercieel gewonnen.[
Deze productiemethode heeft als voordeel dat ongebruikte eiwitrijke biomassa en restanten afkomstig uit verschillende processen als grondstof gebruikt kan worden. Een andere manier is via bacteriële fermentatie, waarbij het aminozuur uit het groeimedium kan worden opgezuiverd.
Acetyltyrosine
In zonnebrandcrèmes wordt regelmatig een derivaat van tyrosine (acetyltyrosine) verwerkt om het bruiningsproces te stimuleren.
Pure tyrosine heeft bij toepassing op de huid geen grote biologische beschikbaarheid omdat het pas vanaf een pH van 11,4 goed oplosbaar is in water.
Acetyltyrosine is een stabiele precursor van tyrosine die door additie van een acetylgroep aan de aminogroep van het aminozuur beter wateroplosbaar is gemaakt.
Theoretisch zou daardoor ook de absorptie vanuit het maag-darmkanaal en het transport over de bloed-hersenbarrière worden verbeterd, reden waarom het soms in voedingssupplementen wordt verwerkt.
Niettemin moet eerst de acetylgroep worden verwijderd voordat de tyrosine biologisch beschikbaar is.
Stofwisseling
Absorptie
Tyrosine wordt in de dunne darm opgenomen via een actief transportmechanisme en vervolgens via de poortader getransporteerd naar de lever, waar het een rol speelt in diverse biochemische reacties, zoals de eiwitsynthese en oxidatief katabolisme.
Tyrosine dat in de lever niet wordt gebruikt, wordt via de bloedbaan naar diverse lichaamsweefsels getransporteerd.
Transport over de bloed-hersenbarrière
Aminozuren en voedingsstoffen moeten in de juiste concentraties in de hersenen aanwezig zijn.
De handhaving hiervan wordt gereguleerd door actieve transportsystemen in de bloed-hersenbarrière. Tyrosine maakt voor het transport over de bloed-hersenbarrière gebruik van hetzelfde transportmechanisme als de andere grote neutrale aminozuren (fenylalanine, L-dopa, tryptofaan, methionine, leucine, isoleucine en valine), namelijk de "large neutral amino acid transporter" (LAT1), oftewel het glycoproteïne CD98.
Er treedt dus concurrentie op om de beschikbare transportcapaciteit. Naarmate de concentratie tyrosine in plasma groter is ten opzichte van die van de andere grote neutrale aminozuren, zal er meer tyrosine de hersenen binnenkomen.
Vanwege deze aminozuurconcurrentie kan het transport van tyrosine over de bloed-hersenbarrière soms problematisch verlopen.
Mogelijk verklaart dit ook de wisselende resultaten van tyrosinesuppletie in klinisch onderzoek op het gebied van hersenfuncties.
Er zijn aanwijzingen dat een verbinding van tyrosine met het essentiële vetzuur alfa-linoleenzuur het transport vergemakkelijkt.
Tyrosine in bloedplasma
Normaalwaarden van tyrosine in bloedplasma variëren tussen 35 en 102 μmol/L wanneer 's ochtends op een nuchtere maag gemeten; bij niet-nuchteren is dat tussen 61 en 99 μmol/L. De plasmawaarden kunnen stijgen tot circa 200 μmol/L na toediening van hoge (150 mg/kg) doses tyrosine aan gezonde personen.[
De plasmapiek wordt na twee uur bereikt en het niveau blijft 6 tot 8 uur boven de uitgangswaarde.
Het circadiaan ritme van de plasmaconcentratie is dat deze gedurende de avond en vroege nacht daalt tot een dieptepunt rond 02:00 à 04:00 uur; de concentratie tyrosine in plasma is het hoogst kort na een maaltijd. Dit patroon wordt anders bij onvoldoende inname van fenylalanine en tyrosine.
Afbraak
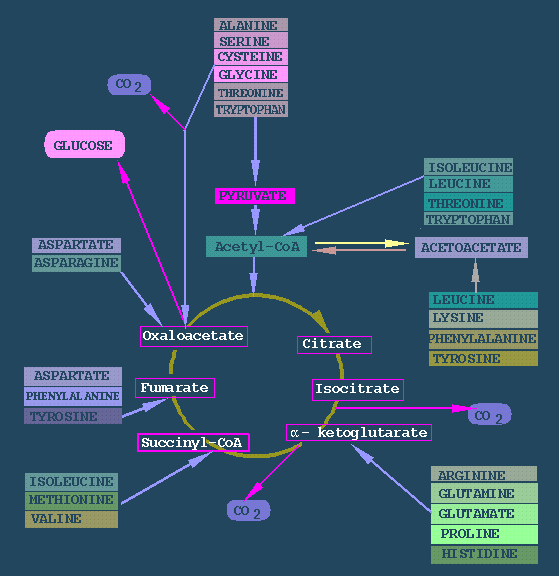
Tyrosine kan in het lichaam worden afgebroken tot acetoacetaat en fumaraat. Deze eindproducten kunnen worden gebruikt in de citroenzuurcyclus.
De afbraak vindt in een aantal stappen plaats onder invloed van verschillende enzymen. Voor de afbraakroute zijn twee dioxygenasen nodig.
Afbraakroute van tyrosine in dieren
De afbraak van tyrosine tot acetoazijnzuur en fumaraat
De eerste stap in de afbraakroute van tyrosine in dieren is de transaminering ervan door het enzym tyrosineaminotransferase. Het tussenproduct para-hydroxyfenylpyruvaat wordt omgezet door para-hydroxyfenylpyruvaatdioxygenase, een enzym dat de decarboxylering en latere verplaatsing katalyseert van de zijketen.
Deze reactie vereist de aanwezigheid van moleculaire zuurstof en ascorbaat als co-enzym. Het product van deze eerste reeks van reacties is homogentisaat (zuurrest van homogentisinezuur).
De aromatische ring van homogentisaat wordt vervolgens opengebroken door O2 onder vorming van 4-maleylacetylacetaat. Deze reactie wordt gekatalyseerd door het (ijzerhoudende) enzym homogentisaatdioxygenase. Het maleylacetoacetaat isomeriseert tot fumarylacetoacetaat welke op zijn beurt splitst in fumaraat en acetoacetaat onder invloed van het enzym fumarylacetoacetaathydrolase.
Fumaraat kan worden gebruikt voor de productie van energie in de citroenzuurcyclus of voor de gluconeogenese.
Acetoacetaat kan worden gebruikt voor synthese van lipiden of voor de productie van energie in de vorm van acetyl-CoA.
Hierdoor is tyrosine (evenals zijn precursor fenylalanine) gemengd ketogeen en glucogeen.
Afwijkingen bij tyrosinestofwisseling
Nitrotyrosine is een stofwisselingsproduct van tyrosine dat in omstandigheden van nitrosatieve stress kan ontstaan.
In omstandigheden van nitrosatieve stress kan nitrotyrosine (3-nitro-L-tyrosine) ontstaan. Deze verbinding ontstaat door inwerking van het reactieve stikstofdeeltje peroxynitriet (nucleofiele aromatische substitutie) op het tyrosinemolecuul.
Nitrotyrosine is in de laboratoriumdiagnostiek een biomarker voor nitrosatieve stress en wordt meestal gezien als een pathologisch fenomeen.
Bij diverse aandoeningen, zoals maagkanker, arteriosclerose, longaandoeningen (o.a. astma), sepsis, vasculitis en andere ontstekingsziekten is de hoeveelheid nitrotyrosine in het serum verhoogd.
Bij de aangeboren stofwisselingsziekte hypertyrosinemie is het lichaam onvoldoende in staat om tyrosine af te breken, waardoor het zich in hoge concentraties in het bloed ophoopt. Daaraan kunnen verschillende enzymdefecten ten grondslag liggen:
Type I tyrosinemie (ook wel tyrosinose genoemd) wordt veroorzaakt door een defect fumarylacetoacetaathydrolase-enzym en gaat gepaard met verstoring van de functie van lever en nieren (renale tubuli).
De leverstoring leidt tot geelzucht en ascites. De nierstoring lijkt op het syndroom van Fanconi. Ook komen rachitis en polyneuropathie voor als symptomen.
De accumulatie van fumarylacetoacetaat en maleylacetoacetaat leidt tot alkylatie van DNA en het ontstaan van tumoren.
De ziekte is een autosomaal recessief overervende aandoening. Wereldwijd treft deze ziekte ongeveer 1 op 100.000 mensen.
Type II tyrosinemie (Richner-Hanhart-syndroom) wordt veroorzaakt door een defect tyrosineaminotransferase-enzym.
Dit gaat gepaard met abnormale traanvorming, lichtschuwheid, pijnlijke en rode ogen, laesies van de ogen en de huid (hyperkeratose). In ongeveer de helft van de gevallen treedt ook microcefalie en mentale retardatie op.
De ziekte is een autosomaal recessief overervende aandoening en treft minder dan 1 op 250.000 mensen.
Type III tyrosinemie wordt veroorzaakt door een defect para-hydroxyfenylpyruvaatdioxygenase-enzym en gaat gepaard met mentale retardatie, toevallen en verlies van coördinatie. De ziekte is extreem zeldzaam, er zijn maar enkele gevallen bekend.
Met name in gevallen van prematuriteit kan ook voorbijgaand tyrosinemie voorkomen. Dit ontstaat door het nog niet volledig werkzame enzym para-hydroxyfenylpyruvaatdioxygenase. In tegenstelling tot andere vormen van tyrosinemie gaat voorbijgaand tyrosinemie vanzelf over doordat de tyrosinestofwisseling zich herstelt.
Andere verstoringen van de normale tyrosineafbraak zijn:
Alkaptonurie. Dit wordt veroorzaakt door een defect homogentisaatdioxygenase-enzym.
Daardoor hoopt een giftig afbraakproduct van tyrosine, namelijk homogentisaat, zich op in het bloed en wordt via de urine uitgescheiden.
Homogentisaat in de urine wordt geoxideerd naar alkapton, wat een bruin-zwarte kleur heeft. In de eerste levensjaren is het enige merkbare gevolg van de ziekte een donkere kleur van de urine.
Maar de pigmenten die worden gevormd bij de oxidatie van homogentisaat hopen zich op in bot- en bindweefsel, waardoor op den duur ochronose kan optreden.
Ook dit is een autosomaal recessieve ziekte. De normale prevalentie schommelt ongeveer tussen 1 op 100.000 en 1 op 250.000.
Hawkinsinurie. Deze zeer zeldzame autosomaal dominant overervende stofwisselingsziekte wordt veroorzaakt doordat de omzetting van tyrosine naar homogentisaat niet juist plaatsvindt.
Het enzym hydroxyfenylpyruvaatdioxygenase die deze omzetting katalyseert vormt het reactieve tussenproduct 1,2-epoxyfenylazijnzuur, maar kan dit in het geval van hawkinsinurie niet omzetten naar homogentisaat.
Dit tussenproduct kan vervolgens reageren tot het zeldzame aminozuur hawkinsin. Hawkinsinurie gaat gepaard met groeistoornissen, abnormaal hoge zuurniveaus in het bloed (acidose) en de vorming van zeer dun haar.
Bij een tyrosine-arm dieet in het eerste levensjaar kunnen de symptomen significant afnemen.
Functies
Precursor van catecholamines
Tyrosine speelt (samen met zijn precursor fenylalanine) een grote rol in het lichaam als precursor voor de catecholamine neurotransmitters/hormonen (dopamine, adrenaline en noradrenaline), welke een belangrijke regulerende functie op de psychische gesteldheid hebben.
Tekorten aan catecholamines worden in verband gebracht met depressie en angsten.
Tyrosine wordt getransporteerd naar catecholamineneuronen in de hersenen, het perifere zenuwstelsel en naar de endocriene cellen in het bijniermerg.
Hier zal de catecholaminesynthese plaatsvinden.
Tyrosine wordt in deze neuronen omgezet in L-dopa onder invloed van het enzym tyrosinehydroxylase.
Net als bij de hydroxylering van fenylalanine naar tyrosine het geval is, is ook deze omzetting van biopterine afhankelijk.
Tyrosinehydroxylase bindt matig met deze cofactor (waarvan de synthese weer afhankelijk is van magnesium, koper, zink, folaat en de vitamines B3, B6, B12).
Mede daardoor is deze hydroxyleringsreactie de snelheidsbepalende stap in de synthese van dopamine en andere catecholamine neurotransmitters/hormonen.
Dopamine kan vervolgens worden omgezet in de catecholamines noradrenaline (norepinefrine) en adrenaline (epinefrine).
Wanneer iemand over onvoldoende tyrosine beschikt, of als het enzym tyrosinehydroxylase onvoldoende actief is, kan er dus een tekort aan catecholamines ontstaan.
De productie van catecholaminen uit tyrosine
De hydroxylering van tyrosine genereert dopa (3,4-dihydrophenylalanine).
Dopa decarboxylase zet vervolgens dopa om in dopamine.
Dopamine β-hydroxylase zet dopamine vervolgens om in noradrenaline. Het enzym fenylethanolamine-N-methyltransferase zet ten slotte noradrenaline om in adrenaline.
In de substantia nigra en sommige andere delen van de hersenen gaat de reactie alleen tot dopamine.
In het bijniermerg wordt dopamine verder omgezet in noradrenaline en adrenaline.
De belangrijkste bepalende factor voor de productie van dopamine en andere catecholamine neurotransmitters is de hoeveelheid vrij tyrosine in de hersenen.
De synthese van catecholamines in de hersenen neemt toe naarmate de hoeveelheid vrij tyrosine in de hersenen stijgt.
De catecholaminesynthese wordt alleen gestimuleerd in neuronen die actief 'afvuren'. Bij cellen in rust die langzaam afvuren blijkt de aanvoer van extra tyrosine geen effect te hebben.
Alle factoren die de concentratie tyrosine in het bloed en het transport over de bloed-hersenbarrière beïnvloeden, beïnvloeden de hoeveelheid vrij tyrosine in de hersenen, en daarmee de synthese van dopamine.
Een sterk bepalende factor daarbij is de eiwitopname via het voedsel, wat mogelijk wijst op een mechanisme om de hersenen te informeren over hoe succesvol het organisme is bij het verkrijgen van eiwit.
De mate van omzetting van tyrosine in dopamine wordt ook beïnvloed door lichamelijke activiteit.
Naarmate de lichamelijke activiteit groter is, wordt er meer dopamine geproduceerd in de hersenen.
Lichamelijke activiteit beïnvloedt de activiteit van tyrosinehydroxylase.
Het antihypertensivum metirosine (merknaam: Demser) remt het enzym tyrosinehydroxylase en leidt zo tot sterk verminderde hoeveelheden dopamine, adrenaline en noradrenaline in het lichaam.
Het werkzame molecuul in metirosine, AMPT (alfa-methyl-para-tyrosine), kan in voldoende concentraties de productie van catecholaminen zelfs volledig tot stilstand brengen.
Waarschijnlijk bindt dit molecuul aan de bindingsplaats voor tyrosine op dit enzym, zonder een biologische respons op te roepen (competitieve remming). De pasvorm is niet exact genoeg om het enzym zijn werk te laten doen, maar voor het eigenlijke substraat is er geen plaats meer. Toediening van AMPT is (naast fenylalanine/tyrosine-restrictie) een manier waarop wetenschappers de effecten van acute depletie van catecholamines bestuderen, onder meer in onderzoek naar depressie.
Precursor van schildklierhormonen
Tyrosine is directe precursor van schildklierhormonen.
Door binding van jodide-moleculen aan tyrosine wordt tri-joodthyronine (T3) en thyroxine (T4) gevormd.
Voor deze binding zijn bepaalde cofactoren nodig, waaronder zink en vitaminen.
Schildklierhormonen zijn essentieel voor normale groei en ontwikkeling, en hebben een belangrijke regulerende werking op de gehele stofwisseling.
Bij hypothyreoïdie krijgt de schildklier onvoldoende tyrosine aangevoerd met een verminderde aanmaak van thyroxine tot gevolg.
Signaaloverdracht
Tyrosine heeft door de aanwezigheid van zijn aromatische zijketen een aantal bijzondere eigenschappen.
Het residu van tyrosine (de fenolische zijketen) speelt een rol bij biochemische communicatieprocessen (signaaltransductie).
Tyrosine maakt deel uit van een bepaalde membraanreceptor, de zogenaamde receptor-tyrosinekinase (RTK).
Membraanreceptoren hebben een extracellulair domein en een intracellulair domein. RTK kan, door de aanwezigheid van signaalmoleculen buiten de cel, met een andere receptor binden, een proces genaamd dimerisatie.
Wanneer dit gebeurt, zullen de intracellulaire domeinen van RTK geactiveerd worden. Dit zijn tyrosine-kinasen. Tussen de geactiveerde domeinen treedt fosforylering op. De aromatische zijketen van tyrosine fungeert als ontvanger van fosfaatgroepen.
In zijn gefosforyleerde toestand wordt tyrosine fosfotyrosine genoemd.
Wanneer de hydroxylgroep van tyrosine gefosforyleerd is, verandert de activiteit van de receptor, waardoor in de cel biochemische veranderingen optreden.
De fosfotyrosinen zijn bindingsplaatsen voor intracellulaire signaaleiwitten. Zij reguleren verdere communicatieprocessen.
Fosfotyrosine kan ook gedetecteerd worden door specifieke antilichamen.
Threonine en serine zijn twee andere aminozuren die de eveneens fosforylering kunnen ondergaan.
Fosforylering van aminozuren wordt beschouwd als een van de belangrijkste stappen in de signaaltransductie en de regulering van enzymatische activiteit.
Tyrosineresiduen kunnen ook gemodificeerd worden door de binding van een sulfaatgroep.
Sulfering van tyrosine wordt gekatalyseerd door het enzym tyrosylproteïne-sulfotransferase (TPST), dat in het membraan van het golgi-apparaat voorkomt, met het actieve deel gericht naar de ruimte binnen het golgi-apparaat (lumen). Net als bij fosfotyrosine het geval is, kan sulfotyrosine gedetecteerd worden door specifieke antilichamen.
Sulfering van tyrosine op gastrine en cholecystokinine versterkt aanzienlijk de werking van beide hormonen.[28]
Precursor van melanine
Albinisme wordt veroorzaakt door een genetisch defect in een enzym dat tyrosine in pigment (melanine) omzet.
Bij dieren en de mens is tyrosine de belangrijkste grondstof voor de productie van melanine.
Verschillende vormen van melanine (met name eumelanine en feomelanine) zijn verantwoordelijk voor de kleur van huid en haar en beschermen de huid tegen ultraviolette straling.
Eumelanine en feomelanine zijn complexverbindingen van melanine met andere stoffen; eumelanine bevat meer tyrosine dan feomelanine.
Eumelanine heeft een donkerbruine tot zwarte kleur,
feomelanine is meer geel-roodachtig.
De omzetting van tyrosine naar melanine verloopt als volgt: onder invloed van uv-straling uit zonlicht wordt de receptor van het melanocyt-stimulerend hormoon (MSH-MC1R) geactiveerd en neemt de concentratie cAMP toe.
Dit leidt tot de expressie van het gen voor tyrosinehydroxylase, waardoor tyrosine kan worden omgezet in L-dopa.
Deze wordt vervolgens geoxideerd tot dopachinon, wat vervolgens wordt omgezet in eumelanine en feomelanine.
In deze aaneenschakeling van complexe reacties is tyrosine het snelheidsbeperkende reagens.
Bij zwartharige katten kan onvoldoende aanvoer van tyrosine de vacht doen verkleuren van zwart naar roodbruin. De hoeveelheid tyrosine die nodig is voor behoud van een zwarte haarkleur is veel groter (ten minste het dubbele) dan de hoeveelheid tyrosine die nodig is voor optimale groei.
Albinisme (type 1) gaat gepaard met afwezigheid of dysfunctie van het tyrosinase-enzym, een koperhoudend enzym dat betrokken is bij de productie van melanine.
Precursor van alkaloïden
De alkaloïden vormen een groep plantaardige organische verbindingen die een sterke fysiologische werking hebben op het menselijk lichaam.
Een belangrijke categorie alkaloïden (strikt genomen: protoalkaloïden) is van tyrosine (en zijn voorloperstof fenylalanine) afgeleid: de fenylethylamine-alkaloïden.
Tot deze groep behoren de catecholamines (dopamine, adrenaline, noradrenaline), maar ook diverse andere alkaloïden hebben tyrosine (of fenylalanine) als uitgangsstof. Voorbeelden zijn mescaline, efedrine, colchicine, morfine, codeïne, papaverine, tubocurarine, noscapine en capsaïcine.
Omzetting van tyrosine naar tyramine
De syntheseroute begint met decarboxylering: door decarboxylering van tyrosine ontstaat tyramine.
Dit gebeurt onder invloed van het enzym tyrosinedecarboxylase (met pyridoxal-5-fosfaat als cofactor).
Tyramine kan op zijn beurt worden omgezet in onder andere dopamine en para-octopamine, een neurotransmitter die nauw verwant is aan noradrenaline.
Bij decarboxylering van fenylalanine ontstaat het sterk met tyramine verwante fenylethylamine.
De klasse verbindingen die door decarboxylatie van een aminozuur ontstaat wordt microamines genoemd.
Op analoge wijze ontstaat tryptamine door decarboxylering van het aminozuur tryptofaan, wat uitgangsstof is voor de synthese van de stofklasse van de tryptamineverbindingen.
Tyramine heeft een stimulerende werking op het sympathisch zenustelsel (sympathicomimeticum) en kan aanleiding geven tot plotselinge bloeddrukstijging en hoofdpijn (het zogenaamde kaassyndroom).
Deze route is vooral relevant in voedingsmiddelen; tyramine ontstaat bij de microbiële afbraak van tyrosine zoals dat plaatsvindt bij fermentatie en bederf.
In vivo wordt tyramine snel afgebroken door monoamine-oxidase (MAO), zodat het normaal gesproken geen effect heeft.
Echter bij personen die MAO-remmers (een categorie antidepressiva) gebruiken, in het bijzonder MAO-A-remmers, kunnen de tyraminespiegels snel stijgen.
Overige eigenschappen en functies
Tyrosine is hoofdgrondstof van betalaïnepigmenten, die verantwoordelijk zijn voor onder meer de rode kleur van bieten
Proteïnesynthese. Tyrosine is een van de 20 α-aminozuren die voor de synthese van lichaamseiwitten worden gebruikt.
Co-enzym Q10. Tyrosine is ook een precursor voor de productie van co-enzym Q10. De omzetting van tyrosine naar co-enzym Q10 is een gecompliceerd proces waar 19 omzettingsstappen voor nodig zijn. Co-enzym Q10 is betrokken bij cellulaire energieproductie.
Antioxidant. Door zijn fenolstructuur bezit tyrosine (milde) antioxidatieve eigenschappen, neutraliseert het aldus diverse radicalen en gaat het peroxidatie van lipiden tegen.
Gluconeogenese. L-tyrosine kan als energiebron benut worden via het proces van gluconeogenese; omzetting door het enzym tyrosinetransaminase in het energiesubstraat pyruvaat.
Fotosynthese. Fotosysteem II bevat een tyrosineresidu. In fotosysteem II functioneert dit residu als een elektronendonor in de reductie van geoxideerd chlorofyl.
De fenolische OH-groep van het residu wordt hierbij gedeprotoneerd. Het zo ontstane neutrale radicaal wordt vervolgens weer gereduceerd door de vierkernige mangaancluster in het fotosysteem II.
Enkefalines. Enkefalinen zijn korte peptideketens die een tyrosineresidu bevatten. Enkefaline heeft opioïde pijnstillende eigenschappen.
Betalaïne. Betalaïnen, wateroplosbare pigmenten, gevonden in de vacuolen van plantencellen, worden gesynthetiseerd uit tyrosine.
Gebruik
Stress
Een groot deel van het onderzoek naar de effecten van tyrosine op stress is uitgevoerd bij soldaten, aangezien gezocht werd naar middelen die hen zouden helpen om beter te presteren in stressvolle omstandigheden.
Chronische stress gaat gepaard met een sneller verbruik van catecholamines in de hersenen en zenuwen.
Deze neurotransmitters worden in granules in de zenuwuiteinden opgeslagen totdat geactiveerde neuronen de voorraad verbruiken voor de prikkeloverdracht.
Aan de andere kant stimuleert stress ook de aanmaak van catecholamines via een sterkere binding van tetrahydrobiopterine aan tyrosinehydroxylase.
Deze hydroxyleringsreactie is de snelheidsbepalende stap in de synthese van dopamine.
Daardoor neemt de aanmaak van catecholamines toe waardoor bij grote of chronische stress de beschikbaarheid van tyrosine een beperkende factor kan worden voor optimaal mentaal functioneren.
Lichamelijke en geestelijke stress blijken vaak gepaard te gaan met verminderde geheugenfunctie en verminderde cognitieve en lichamelijke prestaties.
Een reden daarvoor kan depletie van catecholamines zijn, aangezien deze belangrijk zijn voor cognitieve en motorische vaardigheden.
In dit kader is onderzocht of suppletie van tyrosine de negatieve gevolgen van stress op de mentale prestaties kan tegengaan.
Uit verschillende studies blijkt dat toediening van tyrosine sommige effecten van stress tegengaat, waaronder hypertensie.
Sommige studies zijn uitgevoerd bij militairen, aangezien gezocht werd naar middelen die hen zouden helpen om beter te presteren in stressvolle omstandigheden.
Na toediening van tyrosine bleken jonge soldaten minder negatieve gevolgen (hoofdpijn, koudeperceptie, stress, moeheid, spierpijn) te ondervinden als gevolg van een 4,5 uur lange blootstelling aan kou en ijle lucht dan diegenen die een placebo hadden gekregen.
Zij scoorden beter op diverse parameters die indicatief zijn voor stemming, mentale toestand en cognitief functioneren.[
Soortgelijke effecten zijn gevonden na blootstelling aan cardiovasculaire stress lawaai slaapdeprivatie, kou, multitasking, evenals excessieve lichamelijke inspanning tijdens een zware militaire trainingsmissie.[
Tyrosine leidt niet tot prestatieverbetering op deze terreinen, maar vermindert prestatieverlies als gevolg van stress.
Depressie
Wisselingen in de concentratie van catecholamine neurotransmitters in de hersenen blijken verband te houden met diverse psychische aandoeningen, waaronder geheugenstoornissen en depressie.
De synthese van de meeste neurotransmitters wordt gereguleerd in de hersenen. In de jaren 70 van de vorige eeuw werd duidelijk dat door orale toediening van bepaalde aminozuren de aanmaak van catecholamine neurotransmitters in de hersenen kan worden gestimuleerd.
Aan het einde van de jaren 70 onderzochten verschillende onderzoekers daarom de inzet van deze neurotransmitterprecursors bij depressie, waarbij er aanmerkelijk meer onderzoek is uitgevoerd naar de rol van serotonineprecursors (L-tryptofaan and 5-hydroxytryptofaan) dan naar de rol van precursors van dopamine en noradrenaline (tyrosine en fenylalanine).
Volgens de catecholaminehypothese is een tekort aan dan wel dysfunctie van dopamine en noradrenaline een belangrijke oorzaak van depressie.
Tyrosine, als uitgangsstof voor deze neurotransmitters zou mogelijk depressie kunnen tegengaan.
Onderzoek dat is uitgevoerd om deze hypothese te testen was echter kleinschalig en leverde wisselende resultaten op.
Het uitputten van de tyrosinevoorraden bij gezonde vrijwilligers blijkt symptomen te kunnen opwekken die lijken op die van depressie.
Echter bij een groep voor depressie gevoelige vrouwen bleek dezelfde techniek geen invloed te hebben op de stemming, hoewel er wel een vermindering optrad van de geheugenfunctie.
Mogelijk is tyrosine alleen effectief bij de subgroep van depressies die gepaard gaan met een tekort aan dopamine/noradrenaline en ineffectief bij andere vormen van depressie.
Wanneer de catcholamineniveaus normaal zijn, heeft suppletie met tyrosine geen effect op stemming of cognitieve prestaties.
Ontwenningsverschijnselen
De werking van amfetamines berust op het verhogen van de vrijgifte van dopamine en noradrenaline in de synapsspleet, het tegengaan van de heropname in neuronen en het remmen van het enzym monoamino-oxidase (MAO) dat deze catecholamines afbreekt.
Cocaïne werkt op eenzelfde wijze en doet dat nog iets effectiever omdat het rechtstreeks op het dopamine transporteiwit (DAT1) werkt.
Aan de andere kant remmen zowel cocaïne als amfetamine de aanmaak van dopamine (en andere catecholamines) via remming van het enzym tyrosinehydroxylase.
Depletie van tyrosine en/of dopamine beïnvloedt beloningsmechanismen en is in verband gebracht met destructief gedrag als gevolg van ontregelde biochemische beloningssystemen.
Uitgaande van het idee dat chronisch gebruik van cocaïne uitputting veroorzaakt van de catecholamineniveaus in de hersenen, is onderzocht of tyrosinesuppletie zinvol is in de behandeling van cocaïneverslaving en ontwenningsverschijnselen na het stoppen met cocaïne.
De resultaten zijn echter niet hoopgevend. Ook is op kleine schaal en zonder veel succes geëxperimenteerd met tyrosine in de bestrijding van ontwennigsverschijnselen van cafeïne en nicotine.
Narcolepsie
Aangezien er waarschijnlijk verstoringen van het dopaminerge systeem ten grondslag liggen aan het ontstaan van narcolepsie, is geëxperimenteerd met tyrosinesuppletie met het idee dat hogere dopaminespiegels de symptomen zouden kunnen verminderen. Na enkele hoopgevende berichten, bleek het effect niet reproduceerbaar in gerandomiseerd onderzoek met controlegroep.
Fenylketonurie
Mensen met fenylketonurie (PKU) kunnen geen tyrosine aanmaken uit fenylalanine, vanwege een sterk verminderde activiteit van het leverenzym fenylalaninehydroxylase (PAH).
Voor deze mensen is tyrosine een essentieel aminozuur.
Wanneer zij fenylalanine via de voeding binnenkrijgen, hoopt zich dat op tot toxische niveaus.
De dan uit fenylalanine ontstane stofwisselingsproducten kunnen leiden tot ernstige geestelijke achterstand.
Dat kan worden voorkomen indien in de eerste levensmaand wordt gestart met een fenylalaninebeperkte voeding die wel voldoende tyrosine bevat.
Soms wordt extra tyrosine gegeven, maar het is dan goed de tyrosineniveaus in het bloed te monitoren (normaalwaarde: circa 45 µmol/L), omdat deze gedurende de dag kunnen fluctueren.[18] Tot nu toe is niet gebleken dat het neurofysiologisch functioneren van PKU-patiënten significant kan worden verbeterd door tyrosinesuppletie
Een aantal klinisch relevante stofwisselingsroutes van tyrosine
Een onvermogen om tyrosine in melanine om te zetten veroorzaakt albinisme.
Een onvermogen om tyrosine in schildklierhormonen om te zetten leidt tot hypothyreoïdie en op den duur tot cretinisme.
Alkaptonurie gaat gepaard met een onvermogen om homogentisinezuur (een afbraakproduct van tyrosine) af te breken, waardoor deze stof zich ophoopt tot giftige concentraties.
Ziekte van Parkinson
De ziekte van Parkinson gaat gepaard met lage dopaminespiegels in de hersenen door een vermindering van dopamineproducerende neuronen in de substantia nigra.
Ook is er weinig tyrosinehydroxylase aanwezig, het enzym dat tyrosine in L-dopa omzet.
De gebruikelijke behandeling van de ziekte van Parkinson is orale toediening van L-dopa, het tussenproduct van de omzetting van tyrosine in dopamine. L-dopa toediening put de tyrosinevoorraden uit.
De inzet van tyrosine, precursor van L-dopa, bij parkinsonpatiënten is niet goed onderzocht. Kleinschalig onderzoek uit de jaren 80 van de vorige eeuw en enkele case-studies lijken erop te wijzen dat ook tyrosinesuppletie de dopamineproductie in de hersenen van parkinsonpatiënten kan verhogen, wat gezien de syntheseroute van dopamine ook te verwachten is. Harde conclusies kunnen pas getrokken worden na beter opgezet onderzoek.
ADHD
Er zijn aanwijzingen dat ADHD samenhangt met een verstoring van het dopaminerge en noradrenerge systeem in de hersenen, waardoor daar een dysbalans ontstaat tussen noradrenaline en adrenaline.
De meeste ADHD-medicatie vergroot de beschikbaarheid van dopamine buiten de neuronale cellen in de hersenen, met het doel het evenwicht weer te herstellen.
Tyrosine, als precursor van deze neurotransmitters, is daarom in de wetenschappelijke belangstelling gekomen als potentieel werkzame stof in behandelmethodes.
Uit sommige studies blijkt dat kinderen met ADHD relatief lage spiegels van tyrosine en fenethylamine hebben.
In een studie uit 2011 bleek 77 procent van de kinderen met de diagnose ADHD significant te verbeteren op een behandeling met tyrosine en tryptofaan aangevuld met een aantal cofactoren en adjuvants.
De onderzoekers bepleiten een beter opgezet prospectief gecontroleerd onderzoek om deze behandelmethode verder te onderzoeken.
Vitiligo
Bij de pigmentatieziekte vitiligo is de productie van melanine verstoord.
Vitiligo is een verworven depigmentatie van de huid, waarbij bepaalde organellen (melanosomen) in huidcellen onvoldoende in staat zijn om het aminozuur tyrosine om te zetten in het huidpigment melanine.
Vanwege de diverse functies van tyrosine in het lichaam, treden tekorten relatief gemakkelijk op.
Tyrosine kan aldus gemakkelijk tekortschieten in de melaninevorming.
Vitiligopatiënten hebben vaak simultaan een slechte werking van de schildklier en bijnieren.
Een therapie met de tyrosinevoorloperstof fenylalanine in combinatie met behandeling met uv-licht lijkt hoopgevend maar verder onderzoek is noodzakelijk.
Dit geldt ook voor de behandeling met hoge doseringen van de B-vitamines (foliumzuur en vitamine B12) die betrokken zijn bij de omzetting van tyrosine naar melanine, in combinatie met de blootselling aan zonlicht en UVB.
Overig gebruik
Hoewel er geen gecontroleerde studies zijn uitgevoerd naar deze mogelijke relatie, wordt tyrosine soms gebruikt in de veronderstelling dat het libidoverhogend werkt.
Tyrosine verhoogt de dopamineproductie, een belangrijke factor bij libido.
Tyrosine zou voor een bruinere huid zorgen, de melanogenese stimuleren en de verspreiding van de melanocyten vergroten.
In bruiningsproducten wordt met dit doel actetyltyrosine gebruikt vanwege de betere wateroplosbaarheid.
Deze toepassing is gebaseerd op het feit dat tyrosine voorloper van melanine is, maar is verder onvoldoende onderbouwd met gecontroleerde studies.
Dosering
In wetenschappelijk onderzoek naar de effecten van tyrosine is een veelgebruikte dagdosering 100 tot 150 mg per kilogram lichaamsgewicht.
Voor een volwassene van 70 kg komt dat neer op circa 7 tot 10 gram tyrosine per dag extra boven de inname via eiwitten.
Dergelijk hoge innames dienen alleen onder supervisie van een medicus plaats te vinden. In voedingssupplementen is veelal veel minder aanwezig.
Om concurrentie met andere neutrale aminozuren in de voeding te vermijden, wordt tyrosine vaak gescheiden van de maaltijd ingenomen (vaak wordt een tijdstip ten minste een half uur voor de maaltijd geadviseerd). Niettemin lijkt er weinig invloed te zijn van voedselinname op de beschikbaarheid van tyrosine.
Magnesium, koper, zink, folaat en de vitamines B3, B6, B12 zijn cofactoren bij de omzetting van tyrosine in catecholamines.
Om tekorten van deze nutriënten uit te sluiten wordt tyrosine soms met een multivitaminepreparaat gecombineerd.
Veiligheid
Er worden weinig bijwerkingen gerapporteerd van het gebruik van tyrosine.
Wanneer bijwerkingen gerapporteerd worden, gaat het meestal om misselijkheid, milde diarree, hoofdpijn, vermoeidheid of slapeloosheid bij mensen die hoge doses tyrosine nemen (dagelijks meer dan 150 mg per kg lichaamsgewicht).
Slapeloosheid kan worden voorkomen door tyrosine niet (meer) in de avond in te nemen.
Tyrosine wordt in het algemeen beschouwd als veilig en in de Verenigde Staten heeft de Food and Drug Administration het daarom de GRAS-status ('Generally Recognized As Safe') toegekend.
Bij de volgende aandoeningen kan tyrosine onwenselijke effecten geven. Daarom is medische supervisie noodzakelijk wanneer tyrosine in onderstaande situaties wordt gebruikt:
Psychose en manie: Bij klachten die in verband worden gebracht met een hoog dopaminegehalte, zoals psychose en manie, kan tyrosinesuppletie de klachten verergeren. Depletie van tyrosine heeft een dempend effect op manie.
Antidepressiva: Vanwege het effect van tyrosine op (catecholamine) neurotransmitters kan het effect van antidepressiva worden versterkt, met name wanneer deze de heropname remmen van noradrenaline.
Hypertensie: Bij een al aanwezige hypertensie moet men alert zijn op bloeddrukverhoging door tyrosine bij daarvoor gevoelige personen, zoals bij het gebruik van MAO-remmers.
Schidklierhormoonmedicatie: Bij gebruik van schidklierhormoonmedicatie moet men beducht zijn op een stijging van de thyroxineproductie wanneer ook tyrosine wordt gesuppleerd.
Levodopa: Levodopa (L-dopa) concurreert met tyrosine voor opname in de dunne darm.
Levodopa kan zelfs de opname van tyrosine volledig blokkeren door remming van het transportsysteem,daarom moet er minimaal twee uur verstreken zijn tussen de inname van beide middelen.
Morfine: Hoge doseringen tyrosine konden bij muizen het pijnstillend effect van morfine versterken; mogelijk vindt dit ook plaats bij mensen.
Tyrosine is gecontraïndiceerd bij:
Hypertyrosinemie
Alkaptonurie
Patiënten met een melanoom
Hyperthyreoïdie en ziekte van Graves, als precursor van thyroxine kan tyrosine mogelijk deze aandoeningen verergeren[18]
MAO-remmers: bij gebruik van MAO-remmers bestaat het gevaar dat een behoorlijk deel van de tyrosine wordt omgezet in tyramine, wat kan resulteren in verhoogde bloeddruk en hoofdpijn. Hoewel MAO-remmers nog voorgeschreven worden, zijn ze grotendeels vervangen door SSRI's, die voor zover bekend geen interacties hebben met tyrosine.
Tyrosine en zwangerschap
Zwangere vrouwen met fenylketonurie wordt meestal aangeraden circa 4 gram tyrosine per dag extra in te nemen ter voorkoming van tyrosinedeficiëntie bij de foetus. Een dosis van 1,3 gram is al voldoende om bij de zwangere de serumwaarde voor tyrosine boven het aanbevolen minimum van 45 µmol/L te laten stijgen.[70] Mensen met fenylketonurie kunnen fenylalanine niet of onvoldoende in tyrosine omzetten. Zelfs een lichte fenylketonurie bij een zwangere vrouw kan al aanleiding zijn voor verminderde intellectuele vermogens bij het nageslacht.
Doordat het verband verder nauwelijks is onderzocht, is er geen betrouwbare algemene uitspraak te doen over de veiligheid van tyrosine tijdens de zwangerschap.